Die CNS stellt dem Labor die elektronische Datei zur Verfügung, entsprechend der Beschreibung des Layouts der Genehmigungsdatei (.xsd). Die erforderlichen Daten und deren Bereiche sind im Pflichtenheft Anhang X beschrieben. Die Formatierungen und Strukturen, welche auf der Internetseite der CNS veröffentlicht sind, müssen unbedingt benutzt werden. Jede technische Entwicklung des Layout wird dem Labor mitgeteilt, das dann 3 Monate Zeit hat sich den Änderungen anzupassen.
Der Genehmigungsantrag muss mit dem Muster übereinstimmen, das im Anhang IX des Pflichtenheftes vorgesehen ist. Dieses Dokument ist auf der Internetseite der CNS veröffentlicht.
Verwaltung der Genehmigungsanträge
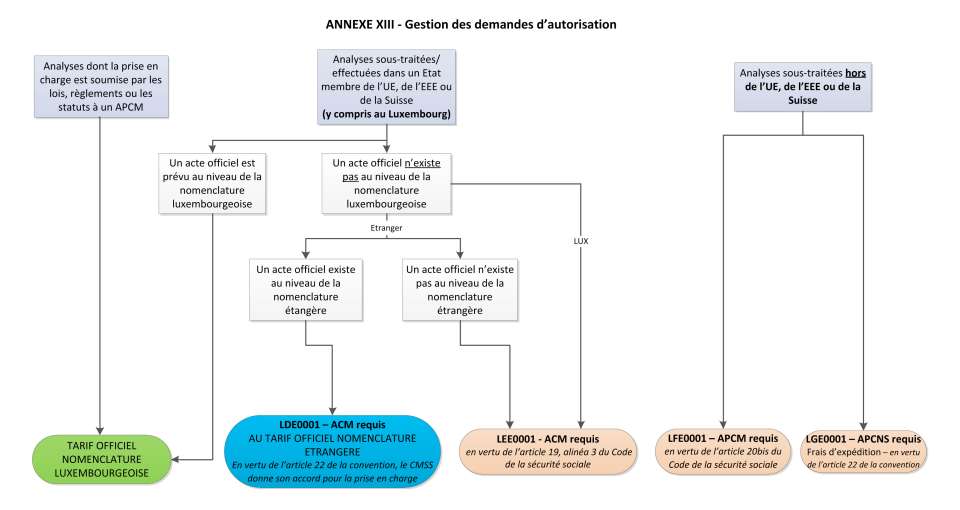
Gemäß den Bestimmungen des Artikels 23 des Pflichtenheftes, in Bezug auf Dokumente und standardisierte Formulare, das zwischen dem Dachverband der Labore für biomedizinische Analysen und der Gesundheitskasse verhandelt wurde, werden folgende kollektive Codes bei den verschiedenen Genehmigungen angewandt:
LDE0001 - Genehmigung des CMSS benötigt
Analyse welche weitergegeben/ausgeführt wurde, entweder in einem anderen Mitgliedstaat, im Europäischen Wirtschaftsraum (EWR) oder in der Schweiz, für die es keinen offiziellen Akt in der Nomenklatur gibt, aber einen in der Nomenklatur der Analysen des Landes (EU, EWR, oder Schweiz), in dem dieser ausgeführt wurde. In diesem Fall wird das Verfahren nach Artikel 22 der Konvention angewandt. Abschnitt 2 sieht dabei folgendes vor:
Wurde die Analyse an ein Labor weitergeleitet, welches sich außerhalb des Großherzogtums Luxemburg befindet, aber in einem Land der Europäischen Union (EU), des Europäischen Wirtschaftsraums (EWR) oder der Schweiz, und kein Tarif in der luxemburgischen Nomenklatur der Labore für biomedizinische Analysen und klinische Biologie vorgesehen ist, wird diese Analyse vom ausländischen Labor nach offiziellem Tarif der Krankenversicherung in dem Staat verrechnet, vorausgesetzt dass sie in den materiellen Anwendungsbereich der luxemburgischen Krankenversicherung fällt und der Kontrollärztlichen Dienst der Sozialversicherung seine Genehmigung für eine Kostenübernahme gegeben hat.
Lorsque l’analyse a été transmise et effectuée dans un laboratoire situé en dehors du Grand-Duché de Luxembourg, mais dans un pays de l’UE, de l’EEE ou en Suisse et qu’un tarif y relatif n’est pas prévu par la nomenclature des actes et services des laboratoires d’analyses médicales et de biologie clinique au Luxembourg, elle est facturée par le laboratoire transmetteur conformément au tarif officiel opposable à l’assurance maladie légale dans l’Etat dans lequel l’analyse a été effectuée, à condition qu’elle tombe dans le champ d’application matériel de l’assurance maladie au Luxembourg, et que le Contrôle médical de la sécurité sociale ait donné son accord pour la prise en charge.
LEE0001 - Genehmigung des CMSS benötigt
Außergewöhnliche Analysen, welche weder in der luxemburgischen Nomenklatur der biomedizinischen Analysen, noch in der Nomenklatur der Analysen des ausländischen Staates (EU, EWR oder Schweiz) aufzufinden ist, in dem diese ausgeführt wurde. Die Prozedur laut Artikel 19, Abschnitt 3, des Gesetzbuches der Sozialen Sicherheit wird angewandt.
LFE0001 - Vorherige Genehmigung des CMSS benötigt
Außergewöhnliche Analysen, welche außerhalb der EU, dem EWR und der Schweiz weitergegeben/ausgeführt wurden und nicht in der Nomenklatur der biomedizinischen Analysen aufgeführt sind. Die Prozedur laut Artikel 20bis des Gesetzbuches der Sozialen Sicherheit wird angewandt.
In Übereinstimmung mit Artikel 19, Abschnitt 3 und Artikel 20bis des Gesetzbuches der Sozialen Sicherheit, erläutert Artikel 22, Abschnitt 3, der Konvention zwischen dem Dachverband der Labore für biomedizinische Analysen und der Gesundheitskasse:
Wenn aber, in Ermangelung eines offiziellen Tarifes, der rechtswirksam bei der legalen Krankenversicherung des Mitgliedstaates ist, in dem sich das Zusammenarbeits-Labor befindet, es einen Tarif in Luxemburg gibt, welcher von der Versicherung übernommen werden kann, ohne jedoch sich in der luxemburgischen Nomenklatur für biomedizinische Analysen und klinische Biologie zu befinden, wird die Rückerstattung der Krankenversicherung gemäß einem vom Kontrollärztlichen Dienst der Sozialversicherung festgelegten Tarif, einer bedeutenden und ebenso gleichwertigen Leistung gleichgestellt. Das gleiche gilt für jene Analysen, die den Bedingungen und Modalitäten entsprechend, außerhalb der EU, des EWR und der Schweiz durchgeführt wurden.
A défaut d’un tarif officiel opposable à l’assurance maladie légale dans l’Etat membre dans lequel le laboratoire de collaboration est établi, mais que l’analyse tombe dans le champ d’application matériel de l’assurance maladie au Luxembourg, sans pour autant figurer dans la nomenclature des actes et services des laboratoires d’analyses médicales et de biologie clinique au Luxembourg, le remboursement par l’assurance maladie se fait sur base d’un tarif fixé par le Contrôle médical de la sécurité sociale assimilant la prestation exceptionnelle à une prestation de même importance. Il en est de même pour les analyses effectuées conformément aux conditions et modalités de la présente convention en dehors d’un pays de l’UE, de l’EEE ou de la Suisse.
LGE0001 - Vorherige Genehmigung der CNS benötigt
Bei Versandkosten für den Transfer der Analysen außerhalb der EU, dem EWR und der Schweiz, wird die Prozedur laut Artikel 22 der Konvention angewandt. Abschnitt 5 erwähnt folgendes:
In Ausnahmefällen, für Analysen die nicht in der luxemburgischen Nomenklatur für biomedizinische Analysen und klinische Biologie aufgeführt sind und auch nicht in Luxemburg durchgeführt werden können, oder in einem Land der EU, des EWR oder der Schweiz, werden die Versandkosten des sendenden Labors für die Proben berücksichtigt. Die Kostenübernahme der Versandkosten unterliegt einer vorherigen Genehmigung der Gesundheitskasse. Dies gilt für den Versand von Analysen in ein Land außerhalb der EU, des EWR und der Schweiz, gemäß dem Artikel 9 der Konvention und einer Begründung der Versandkosten des Labors.
Dans les cas exceptionnels pour des analyses ne figurant pas dans la nomenclature des actes et services des laboratoires d’analyses de biologie médicale et ne pouvant pas être effectuées au Luxembourg ou dans un pays de l’UE, de l’EEE ou en Suisse, il est tenu compte des frais d’expédition exposés par le laboratoire transmetteur pour le transfert des prélèvements. La prise en charge des frais d’expédition est subordonnée à une autorisation préalable de la Caisse nationale de santé pour la transmission des analyses dans un pays en dehors de l’UE, de l’EEE et de la Suisse conformément à l’article 9 de la présente convention et à une justification des frais d’expédition par le laboratoire transmetteur.
Jede Analyse ist Gegenstand eines separaten Antrages.
Anträge auf Versandkostenübernahme für außerhalb der EU, des EWR oder der Schweiz sind auf dem gleichen Dokument abzufassen wie die Analyse. Die Versandkosten sind mit einem Kostenvoranschlag des Spediteurs zu dokumentieren. Die Übernahme der Versandkosten ist mit der dazugehörigen Kostenübernahme der Analyse verbunden.

